1.
久置的铜制品表面会有绿色的铜锈,小乐对铜锈展开了如下研究,回答问题。
(1)
小乐查阅资料发现,铜锈的成分复杂,主要成分有碱式碳酸铜和碱式氯化铜。考古学家从保护铜制品的角度出发,将铜锈分为无害锈和有害锈,结构如图所示:
(2)
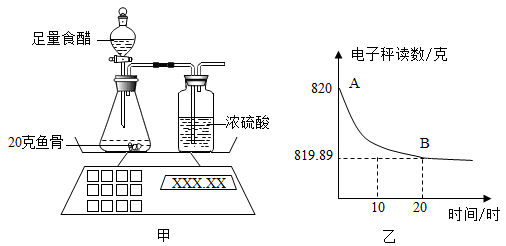
小乐取44.4克纯净的碱式碳酸铜样品,利用图示装置(夹持仪器省略)验证其化学式为Cu2(OH)2CO3。(已知:碱式碳酸铜受热分解可得到氧化铜、水和二氧化碳;碱石灰是氧化钙和氢氧化钠的固体混合物)
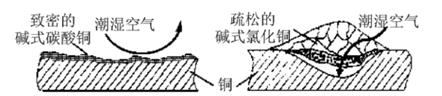
碱式碳酸铜和碱式氯化铜分别属于无害锈和有害锈,解释原因。
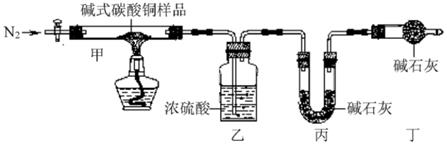
①装置丙的作用是。
②实验前、后均需对装置甲、乙、丙进行称重;当装置甲中固体质量不再减少,对装置甲、乙、丙进行再次称重前,需打开活塞再次通入足量的N2 , 其目的是。
③若碱式碳酸铜的化学式为Cu2(OH)2CO3 , 则装置乙将增重克。
【考点】
根据化学反应方程式的计算;
盐的性质及用途;
能力提升
真题演练