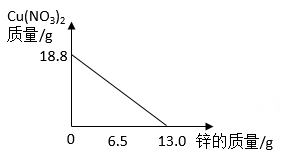
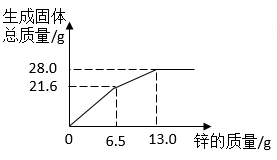
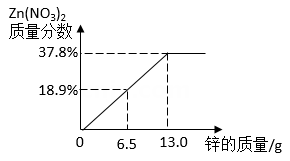
1.
一般不用K、Ca、Na等活泼金属来置换盐溶液中的其他金属元素,这是教科书上的一句话。小科对此进行了思考,并查阅资料,对金属钠和硫酸铜溶液的反应进行探究。
【查阅资料】钠常温下就能与水发生剧烈反应,反应方程式为2Na+2H2O=2NaOH+H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如表所示:
实验编号 | 钠块大小 | 硫酸铜溶液 | 实验中产生沉淀的现象 |
① | 绿豆大小 | 稀溶液10毫升 | 产生蓝绿色沉淀 |
② | 绿豆大小 | 浓溶液10毫升 | 产生蓝色絮状沉淀 |
③ | 豌豆大小 | 稀溶液10毫升 | 产生蓝色絮状沉淀 |
④ | 豌豆大小 | 浓溶液10毫升 | 产生蓝色絮状沉淀,并出现黑色固体 |
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
(1)
【实验结论】
(2)
【实验反思】a.实验中生成氢氧化铜沉淀的原理是。
a.上述实验中均未观察到色固体生成,由此判断猜想一错误。
b.实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
b.由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有。
c.为了用钠置换硫酸铜中的铜元素,小科设计了如下实验方案:
方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水硫酸铜直接混合,隔绝空气加热。
两个方案中,更合理的方案是,理由是。
【考点】
金属的化学性质;
能力提升
真题演练