1.
已知NaHCO3在270℃时完全分解为碳酸钠、水和二氧化碳.而Na2CO3受热不分解.现有某工厂生产出的一批
NaHCO3产品中混有少量的Na2CO3 , 某兴趣小组同学为了测定该产品中NaHCO3的质量分数,设计了下列两种实验方案
方案一:样品稀硫酸测定生成CO2的质量.

(1)
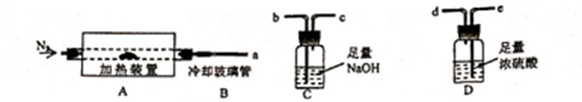
本实验采用如图所示的装置,C中盛放的物质是。
(2)
若把分液漏斗中的稀硫酸改为稀盐酸,在其他操作正确的情况下,(填“能”或”不能“)准确测定样品中NaHCO3的质量分数.
(3)
实验时需要重复“加热、冷却、称量”操作多次.其目的是。
(4)
根据题意,计算样品中NaHCO3的质量分数,写出计算过程.(已知:2NaHCO3  Na2CO3+H2O+CO2↑)
Na2CO3+H2O+CO2↑)
方案二:样品加热测定剩余固体质量. 具体操作步骤如下:
①取一只洁净的坩祸,称得质最为21.2克.冉向其中加入样品,称得总质量为41.2克;
②加热盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为35.0克.
【考点】
实验方案设计与评价;
根据化学反应方程式的计算;
真题演练