1.
某种粗盐水中有少量含  、
、  的杂质,小煦用这种粗盐水经过下列实验流程制取纯净氯化钠晶体。
的杂质,小煦用这种粗盐水经过下列实验流程制取纯净氯化钠晶体。
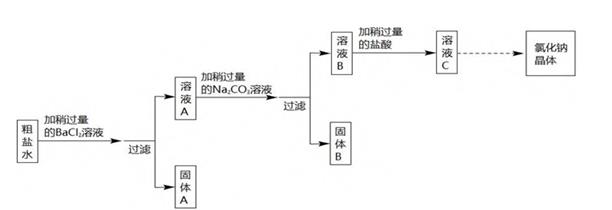
(1)
固体 A 是。(填化学式)
(2)
加碳酸钠溶液时发生反应的化学方程式。
(3)
若将溶液 C 蒸发至出现大量固体时停止加热,利用余热将溶液蒸干得到晶体,所得晶体仍不是纯净的氯化钠,理由是。
【考点】
蒸发操作与粗盐提纯;
书写化学方程式、文字表达式;
能力提升
真题演练



