1.
如图曲线能正确反映下列化学变化中y与x变化关系的是( )
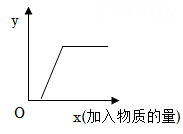
A.
锌粒中滴入稀硫酸:y代表氢气的质量
B.
CaCl2溶液中通入CO2气体:y代表沉淀的质量
C.
氢氧化钠溶液中滴入稀盐酸:y代表混合溶液的pH
D.
CuSO4和HCl的混合溶液中加入NaOH溶液:y代表沉淀的质量
【考点】
酸的化学性质;
二氧化碳的化学性质;
基础巩固
能力提升
变式训练
拓展培优
真题演练
















