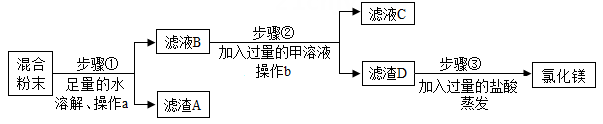
1.
除杂干燥:①溶液除杂:洗气瓶;②固体常温除杂:U形管、干燥管;③固体加热除杂:硬质玻璃管。
干燥与除杂的顺序:①若采用溶液除杂,则先后;②若采用加热除杂,则
在前;③若用固体吸收剂常温除杂,则根据题意而定。
【考点】
物质除杂或净化;
能力提升
变式训练
拓展培优
真题演练