1.
某化学兴趣小组的同学,用下面实验“DIY”的形式探究酸、碱、盐的化学性质。

(1)
【学习交流】
(2)
步骤Ⅱ是在甲中碳酸钙完全消失后,将甲、乙、丙的导管接口重新进行了连接,如图所示。实验中,当观察到乙中液面下降时,丙中同时产生,随后结束实验。
(3)
【提出问题】
(4)
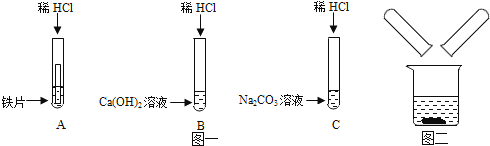
小王同学用三支试管各取少量实验后丙中的溶液,并分别做如下实验:
步骤Ⅰ是向镁带和少量碳酸钙的混合物中加入稀盐酸后关闭分液漏斗的活塞,如图所示。实验中,观察到甲中镁带逐渐减少,碳酸钙逐渐消失,乙和丙中始终只有无色气泡,再无其他明显现象。则气体X是。
实验结束后,丙中溶液的溶质成分是什么?
【做出猜想】
猜想一:NaOH
猜想二:NaOH、Na2CO3
猜想三:NaOH、Ca(OH)2
【实验验证】
小王同学认为选择无色酚酞溶液、Na2CO3溶液、稀盐酸即可验证以上三种合理猜想。
你认为不用上述试剂中的也能达到实验目的。

实验中观察到A中溶液颜色变红,B中无明显现象,C中有气泡生成,则证明猜想成立。
【拓展反思】
实验结束后,将甲、乙、丙中的溶液倒入废液缸中,测得废液的pH=2,则废液中溶质的成分除HCl外,还有种。
【考点】
酸、碱的概念;
酸的化学性质;
碱的化学性质;
能力提升
真题演练