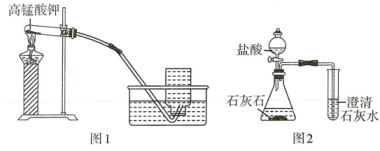
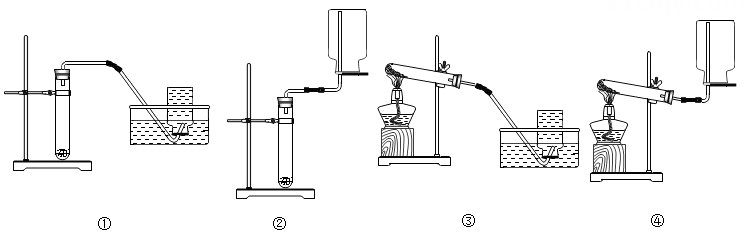
1.
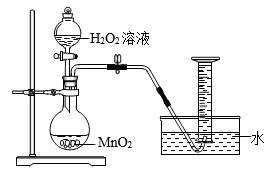
为探究溶液酸碱性对H2O2分解速率的影响,某兴趣小组的同学用如图甲装置,以及实验室提供的所需药品,在常温下进行实验。

(1)
检查装置的气密性:关闭分液漏斗的活塞,微微加热锥形瓶,注射器活塞外移(右移),停止加热后恢复到室温,如果观察到注射器活塞,则说明气密性良好。
(2)
设计实验方案:兴趣小组的同学设计了如下表格,并按照此表格进行了实验。为比较三组
(3)
某同学经过三次实验测得生成氧气的体积随时间变化的关系如图乙所示。分析该图能够得出的实验结论是。
实验中H2O2的分解速率,请将以下表格中的内容补充完善。
|
编 号 |
反应物 |
催化剂 |
|
① |
20mL5%的H2O2溶液+1mL蒸馏水 |
0.1gMnO2 |
|
② |
20mL5%的H2O2溶液+1mL3.65%HCl |
0.1gMnO2 |
|
③ |
20mL5%的H2O2溶液+1mL4%NaOH |
0.1gMnO2 |
【考点】
制取氧气的原理;
能力提升
真题演练