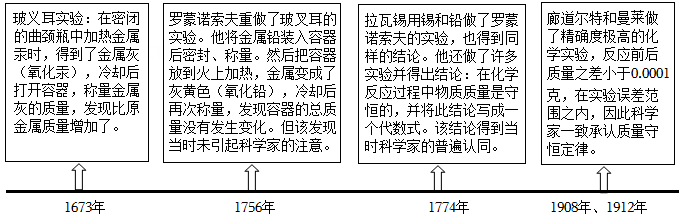
1.
小金同学设计了如下三个实验来验证质量守恒定律:

实验Ⅰ:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量.
实验Ⅱ:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会在称量。
实验Ⅲ:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥型瓶口塞上橡皮塞,称量,然后设法将两种溶液接触(有蓝色氢氧化铜沉淀和硫酸钠生成)过一会再称量。数据见下表:
编号 | 实验I | 实验II | 实验III |
反应前/g | 4.8 | 112.6 | 118.4 |
反应后/g | 8.0 | 112.4 | 118.4 |
(1)
在实验Ⅰ中,反应后的质量比反应前明显增加,请用质量守恒定律加以解释。
(2)
实验Ⅲ的化学方程式是。
(3)
实验Ⅰ、Ⅱ不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处,并提出改进思路。
【考点】
质量守恒定律及其应用;
能力提升
真题演练